


Основы биохимии. Общая химия
Периодическая система элементов Д. И. Менделеева
 А.
Биологически важные химические элементы
А.
Биологически важные химические элементы
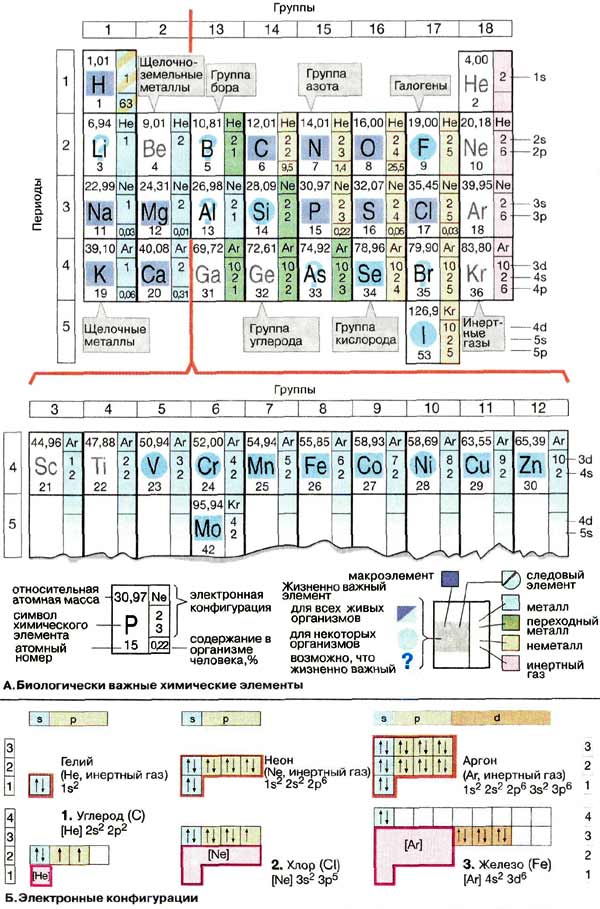
В природе встречается 81 стабильный химический элемент. В состав живой материи входят 15 элементов, еще 8-10 элементов обнаружены только в определенных организмах. На схеме приведена часть Периодической системы элементов, в которой содержатся все биологически важные химические элементы, даны их физические и химические характеристики, а также содержание в живой материи и организме человека. Закономерности строения атомов, лежащие в основе периодической системы, детально рассматриваются в учебниках по химии.
Живые организмы почти на 99% состоят из четырех химических элементов: водорода (Н), кислорода (О), углерода (С) и азота (N). Водород и кислород - составные элементы воды, на которую приходится 60-70% массы клетки (см. с. 198). Наряду с углеродом и азотом эти два элемента являются также основными составляющими органических соединений, участвующих в большинстве процессов жизнедеятельности. Многие биомолекулы содержат также атомы серы (S) и фосфора (Р). Перечисленные макроэлементы входят в состав всех живых организмов.
Химические элементы, относящиеся ко второй важной в биологическом отношении группе и в сумме составляющие примерно 0,5% массы человека, присутствуют, за немногими исключениями, в виде ионов. Эта группа включает щелочные металлы натрий (Na) и калий (К), щелочноземельные металлы магний (Мg) и кальций (Са). Галоген хлор (CI) также всегда присутствует в клетках в форме аниона. Другие жизненно важные (эссенциальные) химические элементы присутствуют в столь малых количествах, что их называют следовыми элементами. Эта группа включает переходные металлы железо (Fe), цинк (Zn), медь (Сu), кобальт (Со) и марганец (Мn). К жизненно важным микроэлементам относятся также некоторые неметаллы, такие, как иод (I) и селен (Se).
Б. Электронные конфигурации
Химические свойства элементов и типы связей, которые они могут образовывать, определяются строением электронной оболочки атомов. На схеме А приведены электронные конфигурации химических элементов. Объяснение символов и сокращений дано на схеме Б. Более детально вопросы строения атомов обсуждаются в учебниках по химии.
Возможные состояния электронов определяются различными энергетическими подуровнями, которые носят название орбиталей. Орбитали характеризуются главным квантовым числом и обозначаются буквами s, p или d. Орбитали заполняются последовательно, одна за другой, по мере увеличения числа электронов. На каждой орбитали могут располагаться только два электрона, которые должны иметь противоположно направленные, антипараллельные, спины ( ↓ и ↑ соответственно). На схеме А приведено распределение электронов на орбиталях для ряда химических элементов. Например, 6 электронов углерода (1) занимают 1s-, 2s-и 2р-орбитали. Заполненная 1s-орбиталь имеет электронную конфигурацию инертного газа гелия (Не). На схемах А и Б эта область электронной оболочки углерода обозначена знаком Не; в правом столбце рядом с химическим знаком на схеме А указаны электроны, занимающие другие заполненные орбитали (2s и 2р в случае углерода). Электронная оболочка атома хлора (2) состоит из оболочки инертного газа неона (Ne) и семи дополнительных электронов, занимающих 3s- и Зр-орбитали. В атоме железа (3), переходном металле первой побочной группы, электроны занимают 4s-орбиталь, при этом 3d-орбитали остаются незаполненными. Многие реакции переходных металлов, например реакции комплексообразования с основаниями, окислительно-восстановительные реакции, проходят с участием незаполненных d-орбиталей.