


Биомолекулы. Пептиды и белки
Глобулярные белки
 В отличие от нерастворимых фибриллярных белков растворимые
белки имеют почти сферическую (глобулярную) форму. Глобулярным белкам свойственна
высокоупорядоченная пространственная структура (конформация), которая
способствует выполнению специфических биологических функций. В данном разделе
разбираются особенности строения глобулярных белков на примере небольшого белка
инсулина (см. сс. 82, 162).
В отличие от нерастворимых фибриллярных белков растворимые
белки имеют почти сферическую (глобулярную) форму. Глобулярным белкам свойственна
высокоупорядоченная пространственная структура (конформация), которая
способствует выполнению специфических биологических функций. В данном разделе
разбираются особенности строения глобулярных белков на примере небольшого белка
инсулина (см. сс. 82, 162).
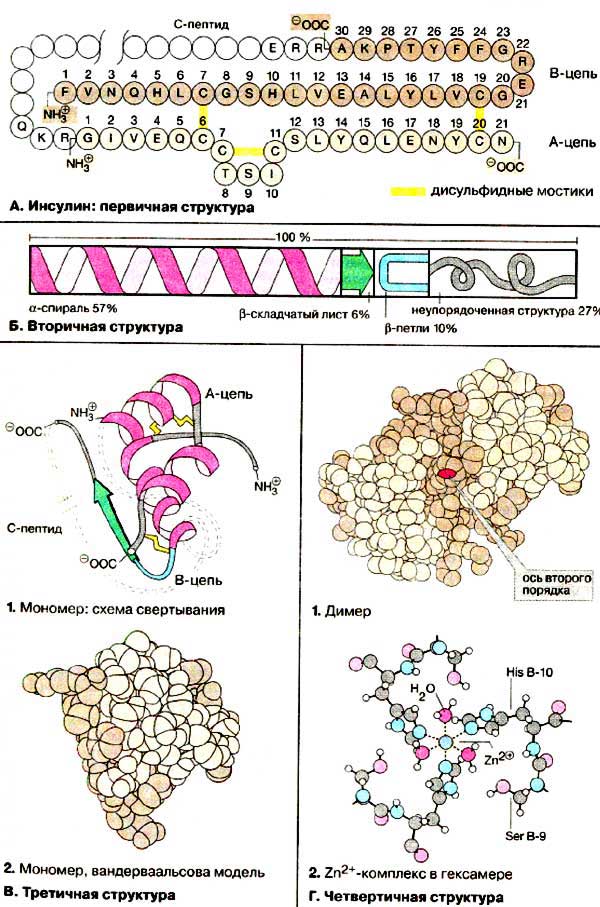
А. Инсулин: первичная структура
Под первичной структурой понимают аминокислотную последовательность полипептидной цепи.
Инсулин был первым белком, строение которого было установлено полностью еще в
начале 50-х годов. Молекула функционально активного инсулина состоит их двух
полипептидных цепей (А- и В-цепи), соединенных дисульфидными
мостиками (на схеме А-цепь окрашена в светло-коричневый цвет,
B-цепь - в темно-коричневый, дисульфидные мостики - в желтый).
Дополнительный дисульфидный мостик локализован в пределах А-цепи. В
поджелудочной железе, где происходит биосинтез инсулина, вначале синтезируется
белок-предшественник - проинсулин, в котором С-концевой аминокислотный
остаток В-цепи связан c Ν-концевым остатком А-цепи 33-членным фрагментом (на
схеме не окрашен). После образования в проинсулине правильно замкнутых
дисульфидных мостиков С-пептид отщепляется протеолитическими ферментами
(см. с. 162).
Б. Вторичная структура
Вторичными структурами называются участки
полипептидной цепи с упорядоченной конформацией, стабилизированной
водородными связями (см. с. 74). В большинстве глобулярных белков
присутствуют одновременно как α-спирали, так и β-складчатые листы.
Кроме того, имеются участки с неупорядоченной структурой.
Распространенным структурным элементом глобулярных белков является
β-петля.
В молекуле инсулина участки, имеющие форму
α-спирали, составляют 57%, 6% приходится на β-складчатую структуру, 10%
построено в виде β-петли, оставшиеся 27%
не имеют упорядоченной структуры.
В. Третичная структура
Трехмерные функционально активные
конформации белков носят название третичной структуры. Третичную
структуру белков исследуют главным образом методом кристаллографии. Этот
трудоемкий метод основан на дифракции рентгеновских лучей на хорошо
сформированных белковых кристаллах. Ha основании дифракционных картин
рассчитывают распределение электронной плотности в кристалле, а по электронной
плотности восстанавливают пространственную структуру молекул белка с атомным
разрешением. В настоящее время определены трехмерные структуры сотен белков.
Однако многие белки пока нельзя изучить этим методом, поскольку их не удается
получить и виде хорошо сформированных кристаллов достаточно крупных
размеров.
Анализ третичной структуры инсулина показал, что в Α-цепи
имеются два коротких участка, а в В-цепи - один длинный участок, построенные
в виде α-спирали (1). При этом N-конец А-цепи
и С-конец В-цепи располагаются в непосредственной близости друг от друга. Единственная
структура типа складчатого листа образуется в димере инсулина (см. Г, 4).
Третичная структура проинсулина еще не установлена.
Г. Четвертичная структура
Белковые молекулы часто образуют симметрично построенные комплексы,
стабилизированные за счет нековалентныч взаимодействий. Такие комплексы называются
олигомерами, а составные единицы комплексов (от 2 до 12) - субъединицами
или мономерами. Инсулин также образует четвертичные структуры. В
крови инсулин присутствует частично в виде димера (1).
Димер имеет ось симметрии второго порядка. Кроме того, в поджелудочной железе
в качестве запасной формы содержится гексамер инсулина (из 6 мономеров),
стабилизированный ионами Zn2+(см с. 162).
В образовании двух комплексов с катионом Zn2+ принимают участие остатки
гистидина в положении B-10 всех шести субъединиц. На схеме 2
показано, что каждый октаэдрический комплекс включает один катион Zn2+,
три остатка гистидина и три молекулы воды (см. также с. 83).