


Биомолекулы. Пептиды и белки
Методы выделения и анализа белков
 Препараты высокоочищенных белков находят разнообразное применение
в научных исследованиях, медицине и биотехнологии. Так как многие белки, и в
особенности глобулярные, высоколабильны (см. с. 80), выделение
проводят с помощью предельно мягких методов и при пониженной температуре (0-5°С).
К таким методам относится ионообменная хроматография, которая обсуждалась
на с. 68. Другие методы выделения белков представлены в
этом разделе.
Препараты высокоочищенных белков находят разнообразное применение
в научных исследованиях, медицине и биотехнологии. Так как многие белки, и в
особенности глобулярные, высоколабильны (см. с. 80), выделение
проводят с помощью предельно мягких методов и при пониженной температуре (0-5°С).
К таким методам относится ионообменная хроматография, которая обсуждалась
на с. 68. Другие методы выделения белков представлены в
этом разделе.
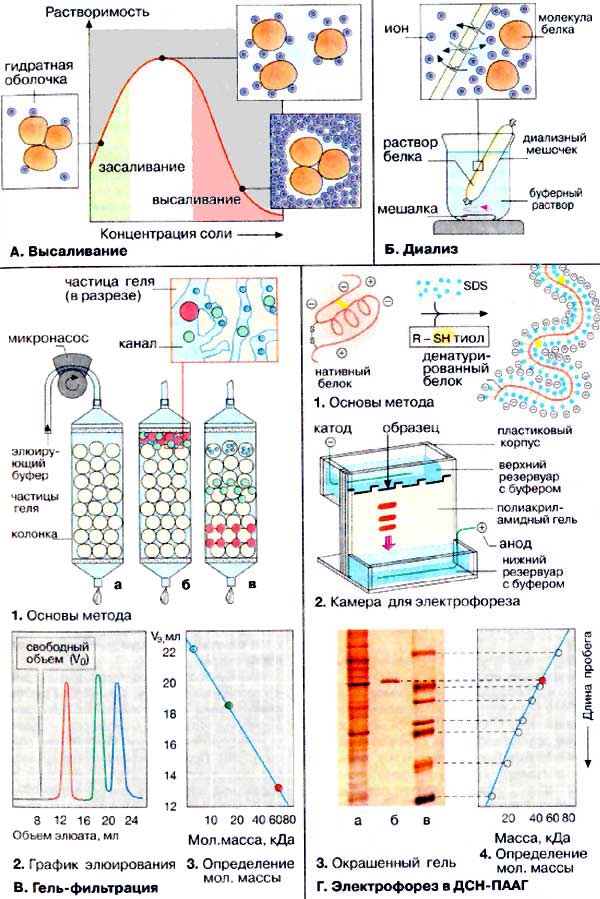
A. Высаливание
Растворимость белков сильно зависит от
концентрации солей (от ионной силы). В дистиллированной воде белки чаще
всего растворяются плохо, однако их растворимость возрастает по мере увеличения
ионной силы. При этом все большее количество гидратированных неорганических
ионов (светло-синие кружочки) связывается с поверхностью белка и тем самым
уменьшается степень его агрегации (засаливание). При высокой ионной силе
молекулы белков лишаются гидратирующих оболочек, что приводит к агрегации и
выпадению белка в осадок (высаливание). Используя различие в
растворимости, можно с помощью обычных солей, например
(NН4)2SО4, разделить (фракционировать) смесь
белков.
Б. Диализ
Для отделения низкомолекулярных примесей или замены состава среды используют диализ. Метод основан на том, что
молекулы белка из-за своих размеров не могут проходить через полупроницаемые
мембраны, в то время как низкомолекулярные вещества равномерно
распределяются между объемом, ограниченным мембраной, и окружающим раствором.
После многократной замены внешнего раствора состав среды в диализном мешочке
(концентрация солей, величина pH и др.) будет тот же, что и в окружающем
растворе.
B. Гель-фильтрация
Гель-проникающая хроматография (гель-фильтрация) позволяет
разделять белки по величине и форме молекул. Разделение проводят в хроматографических
колонках, заполненных сферическими частицами набухшего геля (размером 10-500
мкм) из полимерных материалов (1а). Частицы геля
проницаемы благодаря внутренним каналам, которые характеризуются определенным
средним диаметром. Смесь белков (1б) вносят в колонку
с гелем и элюируют буферным раствором. Белковые молекулы, не способные
проникать в гранулы геля (помечены красным цветом), будут перемещаться с высокой
скоростью. Средние (зеленого цвета) и небольшие белки (синего цвета) будут в
той или иной степени удерживаться гранулами геля (1в).
На выходе колонки элюат собирают в виде отдельных фракций (2).
Объем выхода того или иного белка зависит в основном от его молекулярной массы
(3).
Г. Электрофорез в
полиакриламидном геле в присутствии додецилсульфата натрия
В настоящее время электрофорез в полиакриламидном геле (ПААГ)
в присутствии додецилсульфата натрия (ДСН) [ДСН-ПААГ-электрофорез (SDS-PAGE)]
является общепринятым методом определения гомогенности белковых препаратов.
Метод основан на свойстве заряженных частиц (молекул) перемещаться под действием
электрического поля (см. с. 270). Обычно скорость миграции
зависит от трех параметров анализируемых белков: величины молекул, формы молекул
и суммарного заряда. Поэтому предварительно белки денатурируют с тем, чтобы
скорость миграции зависела только от молекулярной массы. Для этого анализируемую
смесь обрабатывают додецилсульфа-том натрия [ДСН (SDS)] (C12H25OSO3Na),
который представляет собой детергент с сильно выраженными амфифильными
свойствами (см. с. 34). Под действием ДСН олигомерные
белки диссоциируют на субъединицы и денатурируют. Развернутые полипептидные
цепи связывают ДСН (примерно 0,4 г/г белка) и приобретают отрицательный заряд.
Для полной денатурации в среду добавляют тиолы, которые расщепляют дисульфидные
мостики (1).
Электрофорез проводят в тонком слое полиакриламида (2).
После завершения электрофореза, зоны белков выявляют c помощью красителя, В
качестве примера на схеме 3 приведена электрофореграмма
трех препаратов: клеточного экстракта, содержащего сотни белков (а);
выделенного из экстракта гомогенного белка (б);
контрольной смеси белков с известными молекулярными массами (в).