


Метаболизм. Ферменты
Ферментативный катализ
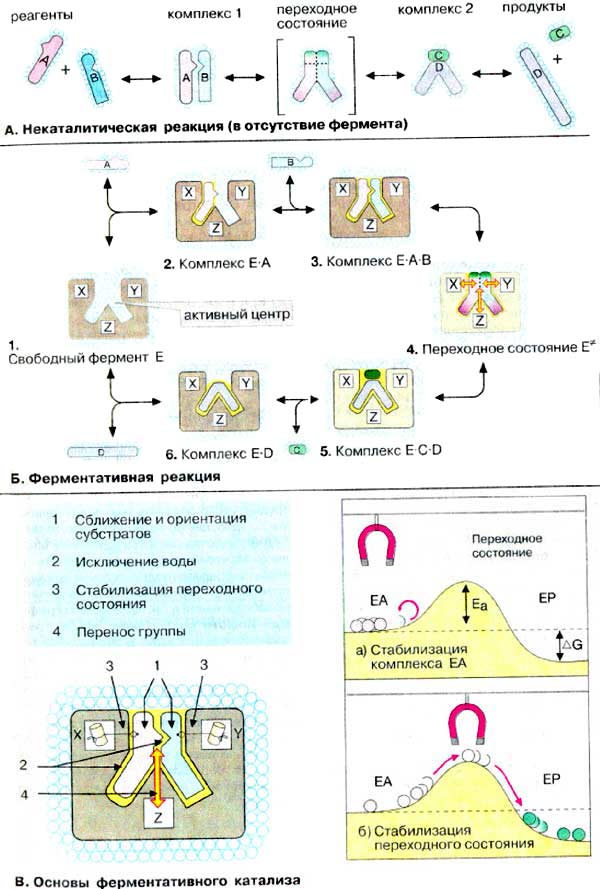 Ферменты - высокоэффективные
катализаторы. Они повышают скорость катализируемой реакции в
1012 раз и более. Для понимания механизма ферментативного катализа
полезно прежде всего рассмотреть протекание некаталитической
реакции.
Ферменты - высокоэффективные
катализаторы. Они повышают скорость катализируемой реакции в
1012 раз и более. Для понимания механизма ферментативного катализа
полезно прежде всего рассмотреть протекание некаталитической
реакции.
А. Некаталитическая реакция (в отсутствие
фермента)
В качестве примера рассмотрим реакцию типа А + В → С
+ D. Вещества A и В в растворе окружены оболочкой из молекул воды (гидратной
оболочкой) и под действием теплового движения перемещаются случайным образом.
Они могут вступать в реакцию друг с другом только в том случае, когда сталкиваются
в благоприятной ориентации, что маловероятно и происходит редко. Для образования
продуктов C + D комплекс A-В, возникший в результате соударения молекул,
должен образовать переходное состояние, для чего требуется, как правило,
значительная энергия активации Ea (см. с. 28).
Поскольку получить эту энергию может только небольшая часть комплексов A-В,
достижение переходного состояния - еще более редкий случай, чем возникновение
комплекса. В растворе большая часть анергии активации расходуется на преодоление
гидратных оболочек между A и В, сближение реагентов и другие химические
процессы, в которых эти реагенты участвуют. В результате в отсутствие катализатора
образование продуктов происходит крайне редко и скорость реакции v незначительна,
даже когда реакция термодинамически допустима, т. е. ΔG < 0 (см. с.
22).
Б. Ферментативная реакция
Ферменты специфически связывают реагенты (свои субстраты) в
активном центре. При этом субстраты ориентируются таким образом, что
приобретают оптимальное положение для образования переходного состояния
(1-3). Сближение и необходимая ориентации
реагентов значительно повышают вероятность образования продуктивного
комплекса A-B. Кроме того, связывание субстрата в активном центре приводит
к удалению гидратной оболочки субстрата.В результате удаления молекул воды
в активном центре фермента во время катализа создаются совершенно другие
условия, чем в растворе (3-5). Еще одним важным
фактором является стабилизация переходного состояния вследствие взаимодействия
между аминокислотными остатками белка и субстратом (4).
Таким образом, переходное состояние в случае ферментативной реакции требует
меньшей энергии активации. Кроме того, многие ферменты во время катализа переносят
специфические группировки с субстрата или на субстрат. Особенно часто осуществляется
перенос протонов. Этот ферментативный кислотно-основной катализ значительно
более эффективен, чем обмен протонов с кислотами и основаниями в растворе. Часто
химические группировки ковалентно присоединяются к остаткам фермента. Это явление
называют ковалентным катализом. Принципы ферментативного катализа разъяснены
на с. 104 на примере лактатдегидрогеназы.
В. Основы ферментативного
катализа
Несмотря на то, что сегодня трудно количественно оценить вклад
отдельных каталитических эффектов, решающим фактором считается стабилизация
переходного состояния в активном центре фермента. При этом наиболее существенным
моментом является прочное связывание не столько субстрата, сколько его переходного
состояния. Данное положение подтверждается крайне высоким сродством многих ферментов
по отношению к аналогам переходного состояния (см. c. 100),
что можно пояснить простой механической аналогией (на схеме справа): если хотят
перекатить металлические шарики (реагенты) с места EA (состояние субстрата)
в энергетически более высокое переходное состояние, а затем в EP (состояние
продукта), нужно расположить магнит (катализатор) таким образом, чтобы сила
притяжения действовала не на EA (а), а на переходное
состояние (б).