


Метаболизм липидов
Биосинтез
холестерина
 Холестерин - важная составная часть
клеточных мембран животных клеток (см. с. 218). Суточная потребность в
холестерине (1 г) может в принципе покрываться за счет биосинтеза. При
смешанной диете примерно половина суточной нормы холестерина синтезируется в
кишечнике, коже и главным образом в печени (примерно 50%), а остальной
холестерин поступает с пищей. Значительная часть холестерина включена в липидный
слой плазматических мембран. Большое количество холестерина расходуется в
биосинтезе желчных кислот (см. с. 306), часть выделяется с желчью.
Ежесуточно из организма выводится примерно 1 г холестерина. Очень небольшая
часть холестерина используется для биосинтеза стероидных гормонов (см. с.
364).
Холестерин - важная составная часть
клеточных мембран животных клеток (см. с. 218). Суточная потребность в
холестерине (1 г) может в принципе покрываться за счет биосинтеза. При
смешанной диете примерно половина суточной нормы холестерина синтезируется в
кишечнике, коже и главным образом в печени (примерно 50%), а остальной
холестерин поступает с пищей. Значительная часть холестерина включена в липидный
слой плазматических мембран. Большое количество холестерина расходуется в
биосинтезе желчных кислот (см. с. 306), часть выделяется с желчью.
Ежесуточно из организма выводится примерно 1 г холестерина. Очень небольшая
часть холестерина используется для биосинтеза стероидных гормонов (см. с.
364).
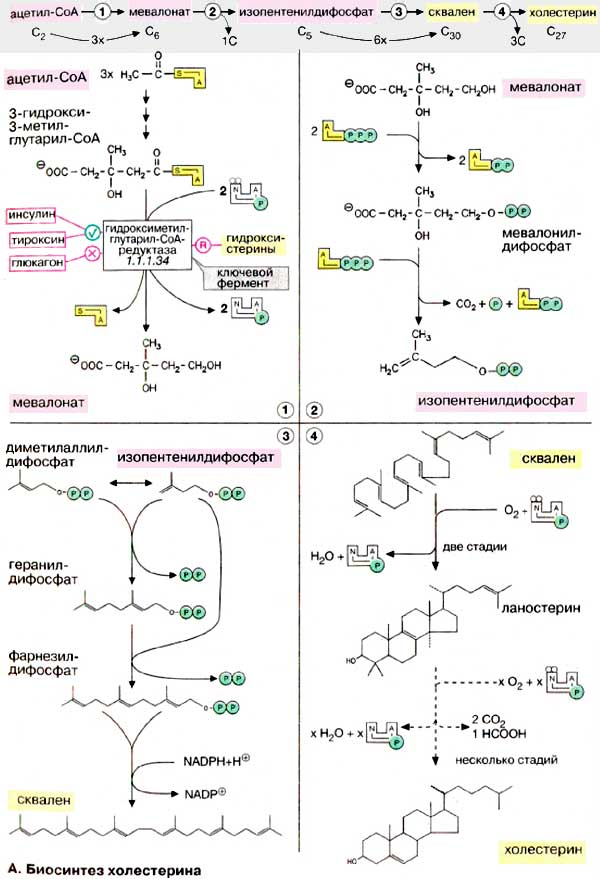
А. Биосинтез холестерина
Биосинтез холестерина, кап и всех
изопреноидов, начинается с ацетил-КоА (см. с. 58). Углеродный скелет
С27-стерина строится из С2-звеньев в длинной и сложной
последовательности реакций. Биосинтез холестерина можно разделить на четыре
этапа. На первом этапе (1) из трех молекул ацетил-КоА образуется
мевалонат (С6). На втором этапе (2) мевалонат превращается в
'активный изопрен', изопентенилдифосфат. На третьем этапе (3) шесть
молекул изопрена полимеризуются с образованием сквалена (С30).
Наконец, сквален циклизуется с отщеплением трех атомов углерода и превращается в
холестерин (4). На схеме представлены только наиболее важные промежуточные
продукты биосинтеза.
1. Образование мевалоната.
Превращение ацетил-КоА в ацетоацетил-КоА и затем в
З-гидрокси-З-метилглутарил-КоА (3-ГМГ-КоА) соответствует пути биосинтеза
кетоновых тел (подробно см. рис. 305), однако этот процесс происходит не в
митохондриях, а в эндоплазматическом ретикулуме (ЭР). 3-ГМГ-КоА
восстанавливается с отщеплением кофермента А с участием
3-ГМГ-КоА-редуктазы, ключевого фермента биосинтеза холестерину (см.
ниже). На этом важном этапе путем репрессии биосинтеза фермента (эффекторы:
гидроксистерины), а также за счет взаимопревращения молекулы фермента
(эффекторы: гормоны) осуществляется регуляция биосинтеза холестерина.
Например, фосфорилированная редуктаза представляет собой неактивную форму
фермента; инсулин и тироксин стимулируют фермент, глюкагон тормозит; холестерин,
поступающий с пищей, также подавляет 3-ГМГ-КоА-редуктазу.
2. Образование изопентенилдифосфата. Мевалонат за счет
декарбоксилирования с потреблением АТФ превращается в изопентенилдифосфат,
который и является тем структурным элементом, из которого строятся все изопреноиды
(см. рис. 59).
3. Образование сквалена.
Изопентенилдифосфат подвергается изомеризации с образованием
диметилаллилдифосфата. Обе С5-молекулы конденсируются в
геранилдифосфат и в результате присоединения следующей молекулы
изопентенилдифосфата образуют фарнезилдифосфат. При димеризации последнего по
типу 'голова к голове' образуется сквален. Фарнезилдифосфат является
также исходным соединением для синтеза других полиизопреноидов, таких, как
долихол и убихинон (см. с. 58).
4. Образование холестерина.
Сквален, линейный изопреноид, циклизуется с потреблением кислорода в
ланостерин, С30-стерин, от которого на последующих стадиях,
катализируемых цитохромом Р450, отщепляются три метильные группы,
вследствие чего образуется конечный продукт - холестерин.
Описанный путь биосинтеза локализован в
гладком ЭР. Синтез идет за счет энергии, освобождающейся при расщеплении
производных кофермента А и энергетически богатых фосфатов. Восстановителем при
образовании мевалоната и сквалена, а также на последних стадиях биосинтеза
холестерина является НАДФН + Η+. Для этого пути характерно то, что
промежуточные метаболиты можно подразделить на три группы: производные
кофермента А, дифосфаты и высоко липофильные соединения (от сквалена до
холестерина), связанные с переносчиками стеринов.