


Ткани и органы. Кровь
Гемоглобин
 Главная функция эритроцитов
(см. с. 268)
- транспорт кислорода от легких в ткани и СО2 от тканей
обратно в легкие. Высшие организмы нуждаются для этого в специальной
транспортной системе, так как молекулярный кислород плохо растворим в воде:
в 1 л плазмы крови растворимо только около 3,2 мл О2.
Содержащийся в эритроцитах белок гемоглобин (Hb) способен связать
в 70 раз больше - 220 мл О2/л. Содержание Hb в крови составляет
140-180 г/л у мужчин и 120-160 г/л у женщин, т. е. вдвое выше по сравнению с
белками плазмы (50-80 г/л). Поэтому Hb вносит наибольший вклад в образование
рН-буферной емкости крови (см. с. 280).
Главная функция эритроцитов
(см. с. 268)
- транспорт кислорода от легких в ткани и СО2 от тканей
обратно в легкие. Высшие организмы нуждаются для этого в специальной
транспортной системе, так как молекулярный кислород плохо растворим в воде:
в 1 л плазмы крови растворимо только около 3,2 мл О2.
Содержащийся в эритроцитах белок гемоглобин (Hb) способен связать
в 70 раз больше - 220 мл О2/л. Содержание Hb в крови составляет
140-180 г/л у мужчин и 120-160 г/л у женщин, т. е. вдвое выше по сравнению с
белками плазмы (50-80 г/л). Поэтому Hb вносит наибольший вклад в образование
рН-буферной емкости крови (см. с. 280).
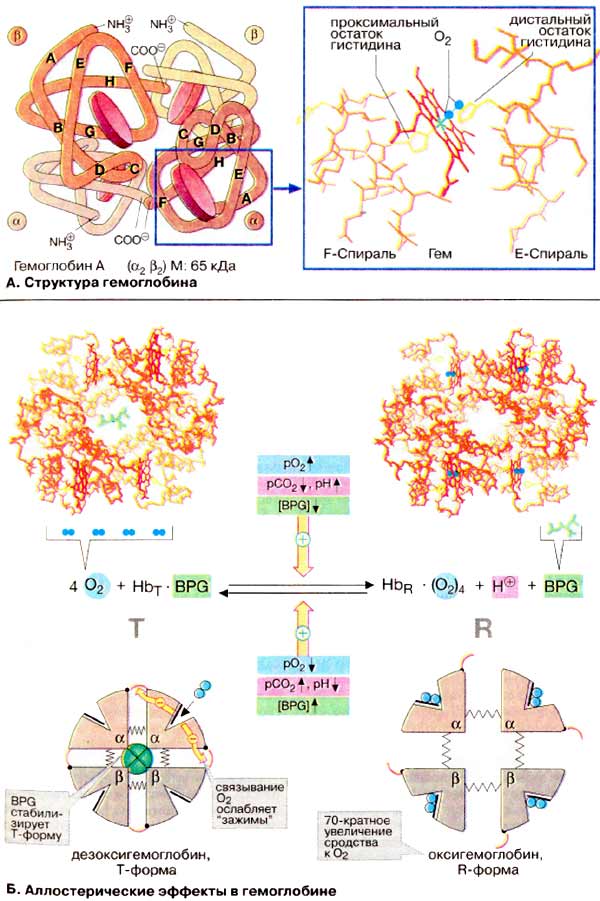
А. Структура
гемоглобина
Гемоглобин взрослого организма
(HbA, см. ниже) является тетрамером, состоящим из двух α- и двух
β-субьединиц с молекулярными массами примерно 16 кДа. α- и β-цепи отличаются
аминокислотной последовательностью, но имеют сходную конформацию. Примерно 80%
аминокислотных остатков глобина образуют α-спирали, обозначенные буквами
А-Н (см. схему). Каждая субъединица несет группу гема (формулу см. на рис.
197) с ионом двухвалентного железа в центре. При связывании
O2 с атомом железа в геме (оксигенация Hb) и отщеплении
O2 (дезоксигенация) степень окисления атома железа не
меняется. Окисление Fe2+ до Fe3+ в геме носит случайный
характер. Окисленная форма гемоглобина, метгемоглобин, не способна
переносить O2. Доля метгемоглобина поддерживается ферментами на
низком уровне и составляет поэтому обычно только 1-2%.
Четыре из шести координационных связей
атома железа в гемоглобине заняты атомами азота пиррольных колец, пятая -
остатком гистидина глобина (проксимальный остаток гистидина), а шестая -
молекулой кислорода в оксигемоглобине и, соответственно, Н2О в
дезоксигемоглобине.
Б. Аллостерические эффекты в
гемоглобине
Аналогично аспартат-карбамоилтрансферазе
(см. с. 118) Hb может находиться в двух состояниях (конформациях):
обозначаемых как Т- и R-формы соответственно. Т-Форма (напряженная от
англ. tense) обладает существенно более низким сродством к O2
по сравнению с R-формой (на схеме справа). Связывание O2 с одной из
субъединиц Т-формы приводит к локальным конформационным изменениям, которые
ослабляют связь между субъединицами. С возрастанием парциального давления
O2 увеличивается доля молекул Hb в высокоаффинной R-форме (от англ.
relaxed). Благодаря кооперативным взаимодействиям между субъединицами с
ростом концентрации кислорода повышается сродство Hb к O2, в
результате чего кривая насыщения имеет сигмоидальный вид (см. с
276).
На равновесие между Т- и R-формами
влияют различные аллостерические эффекторы, регулирующие связывание
O2 гемоглобином (желтые стрелки). К наиболее важным эффекторам
относятся CO2, Н+ и 2,3-дифосфоглицерат [ДФГ (BPG)]
(см. с. 276).
Дополнительная
информация
Hb взрослого организма состоит, как
упомянуто выше, из двух α- и двух β-цепей (α2β2). Наряду с
этой основной формой (HbA1) в крови присутствуют
незначительные количества второй формы с более высоким сродством к
O2, у второй β-цепи заменены δ-цепя-ми (HbA2,
α2δ2). Две другие формы Hb встречаются только в
эмбриональном периоде развития. В первые три месяца образуются эмбриональные
гемоглобины состава ξ2ε2 и α2γ2.
Затем вплоть до рождения доминирует фетальный гемоглобин (HbF,
α2δ2), который постепенно заменяется на первом месяце
жизни на HbА. Эмбриональный и фетальный гемоглобины обладают более высоким
сродством к О2 по сравнению с HbА, так как они должны переносить
кислород из системы материнского кровообращения.