


Метаболизм. Ферменты
Лактатдегидрогеназа: структура
 В этом разделе в качестве примера
взаимосвязи структуры и функции фермента более подробно рассмотрена
лактатдегидрогеназа [ЛДГ (LDH), КФ 1.1.1.27].
В этом разделе в качестве примера
взаимосвязи структуры и функции фермента более подробно рассмотрена
лактатдегидрогеназа [ЛДГ (LDH), КФ 1.1.1.27].
А. Лактатдегидрогеназа: структура
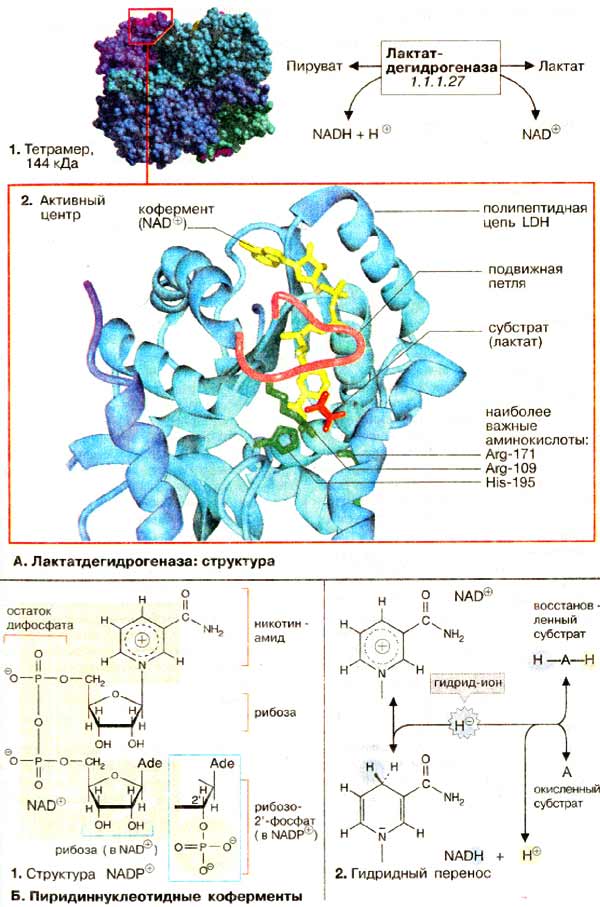
Активной формой лактатдегидрогеназы
(молекулярная масса 144 кДа) является тетрамер из 4 субъединиц (1) Каждая
субъединица образована пептидной цепью из 334 аминокислот (36 кДа). В тетрамере
субъединицы занимают эквивалентные положения (1); каждый мономер содержит
активный центр.
В организме млекопитающих имеются два
различных типа субъединиц ЛДГ (H и M), незначительно различающиеся по
аминокислотной последовательности; они могут ассоциировать в тетрамер случайным
образом. Поэтому известно 5 различных изоферментов ЛДГ. В мышце сердца
содержатся преимущественно тетрамеры, состоящие из Н-субъединиц (H от англ.
heart), в ЛДГ печени и скелетных мышц преобладают М-мономеры.
Активный центр в субъединице ЛДГ схематически показан на рис.
2. При этом пептидный остов белка изображен в виде
ленты (светло-голубой), дополнительно представлены молекулы: субстрата - лактата
(красного цвета), кофермента НАД+ (желтого цвета) и три
боковые цепи аминокислот (зеленого цвета), которые участвуют непосредственно
в катализе. Кроме того, выделена пептидная петля (малинового цвета),
образованная аминокислотными остатками 98-111. В отсутствие субстрата и кофермента
эта структура раскрыта, что обеспечивает свободный доступ к субстратсвязывающему
участку (не показано). На рисунке представлен блокированный активный центр в
комплексе фермент-лактат-НАД+. Детали каталитического цикла лактатдегидрогеназы
обсуждаются в следующем разделе.
Б. Пиридиннуклеотидные коферменты
Все дегидрогеназы нуждаются в коферменте для переноса
восстановительных эквивалентов (см. с. 108). Наиболее
широко распространены коферменты динуклеотидного типа (см. с. 86),
в котором два нуклеозид-5'-монофосфата соединены фосфоангидридной
связью. ЛДГ и многие другие дегидрогеназы нуждаются в никотинамидадениндинуклеотиде,
сокращенно НАД+ (NAD+) (1).
Обе нуклеотидных группы НАД+ построены из 5'-АМФ и нуклеотида, содержащего
в качестве основания амид никотиновой кислоты (см. с. 354).
Структурно (но не функционально) похожим коферментом является НАДФ+
(NADP+), в котором 2'-ОН-группы рибозы аденина дополнительно связаны
с фосфатом. Несмотря на близкое структурное родство НАД+ и НАДФ+
осуществляют различные функции в обмене веществ (см. с. 114).
В окислительно-восстановительных реакциях пиридиннуклеотидного
кофермента участвует только никотинамидное кольцо (2).
Никотинамид является амидом пиридин-3-карбоновой (никотиновой) кислоты.
В окисленной форме кольцо имеет ароматический характер и несет положительный
заряд. По этой причине кофермент в окисленном состоянии обозначают как НАД+.
При окислении лактата дегидрогеназа отщепляет от субстрата (AH2)
два атома водорода [т. е. два электрона и два протона (2,
середина)]. Однако на НАД+ переносится только гидрид-ион (H-,
два электрона и один протон). Акцептором гидрид-иона является атом углерода
в пара-положении к атому азота кольца НАД+. В этом месте образуется
алифатическая СН2-группа, перестраиваются двойные связи кольца и
исчезает положительный заряд (2, внизу). При окислении
или восстановлении никотинамидного кольца изменяются также спектральные характеристики
кофермента. Поэтому за реакцией можно легко следить фотометрически (см. с. 106).
Второй протон высвобождается в среду и,
следовательно, правильное наименование восстановленной формы кофермента NADH
+ H+, а не NADH2.