


Метаболизм белков
Деградация аминокислот
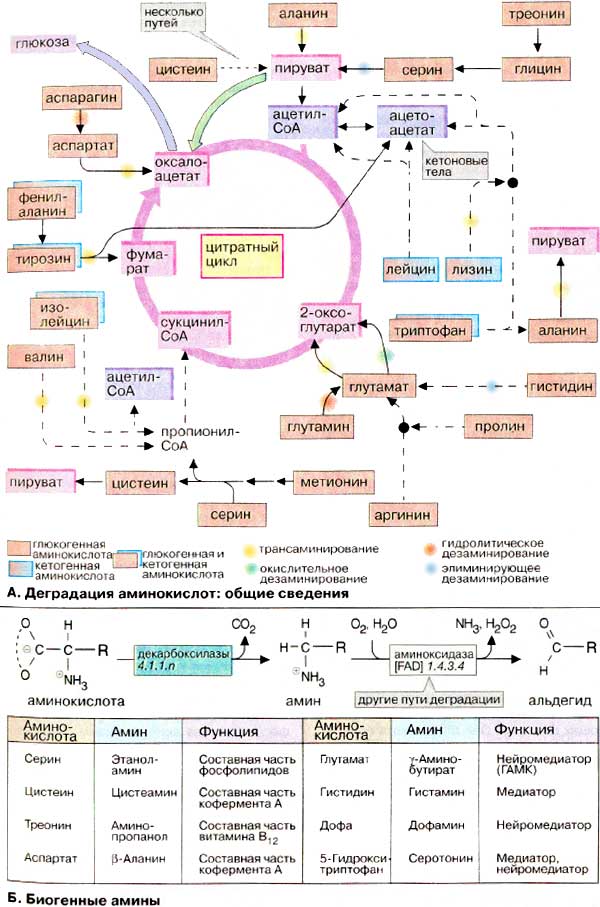 В
обзоре представлены многочисленные пути метаболизма аминокислот. Дополнительные
подробности приведены на сс. 402 и 403.
В
обзоре представлены многочисленные пути метаболизма аминокислот. Дополнительные
подробности приведены на сс. 402 и 403.
А. Деградация аминокислот: общие
сведения
Углеродные скелеты 20 белковых
аминокислот (см. с. 66) превращаются в итоге в семь различных продуктов
деградации (на схеме окрашены в розовый и светло-голубой цвета). Пять
метаболитов (2-оксоглутарат, сукцинил-КоА, фумарат, оксалоацетат и пируват)
служат предшественниками в процессе глюконеогенеза (см. с. 156). Первые
четыре являются еще и промежуточными продуктами цитратного цикла, в то время как
пируват может быть переведен пируватдекарбоксилазой в оксалоацетат и тем
самым стать участником глюконеогенеза (зеленая стрелка). Аминокислоты,
деградация которых поставляет один из пяти упомянутых метаболитов, называются
глюкогенными аминокислотами. За двумя исключениями (лизин и лейцин, см.
ниже) глюкогенными являются все белковые аминокислоты.
Два других продукта распада (ацетоацетат и ацетил-КоА) не могут
включаться в глюконеогенез в организме животных. Они используются для синтеза
кетоновых тел, жирных кислот и изопреноидов (см. сс. 174,
304). Поэтому аминокислоты, которые разрушаются с образованием
ацетил-КоА или ацетоацетата, называются кетогенными аминокислотами. Фактически
кетогенными являются только лейцин и лизин. Некоторые аминокислоты поставляют
продукты деградации, являющиеся глюкогенами и кетогенами. К этой
группе принадлежат фенилаланин, тирозин, триптофан и изолейцин.
Существует несколько путей удаления
аминогруппы во время распада аминокислоты (дезаминирования). Обычно
NH2-группа переносится путем трансаминирования на
2-оксоглутарат (см. с. 180, желтые метки на схеме). Образующийся глутамат в
дальнейшем вновь превращается в 2-оксоглутарат с помощью
глутаматдегидрогеназы (окислительное дезаминирование, зеленая
метка). В этой реакции образуется свободный аммиак (NH3), который у
высших животных превращается в мочевину и выводится из организма (см. с. 184).
Аммиак освобождается также при гидролизе амидных групп аспарагина и глутамина
(гидролитическое дезаминирование, оранжевая метка). Другим превращением,
при котором образуется NH3, является элиминирующее
дезаминирование серина в пируват (голубая метка, см. с. 402).
Б. Биогенные амины
Моноамины, так называемые биогенные
амины, образуются при декарбоксилирование аминокислот. Некоторые из
этих соединений являются составными частями других биомолекул. Так. в состав
фосфолипидов (см. с. 56) кроме аминокислоты серина может входить соответствующий
биогенный амин этаноламин. Цистеамин и β-аланин являются
структурными элементами кофермента А (см. с. 110) и пантетеина (см. с. 170).
Образованный из треонина аминопропанол является структурным элементом
витамина B12 (см. с. 356).
Некоторые биогенные амины действуют как
сигнальные вещества. Важным нейромедиатором является образующаяся из
глутамата γ-аминомасляная кислота [ГАМК (GABA), см. с. 338]. Другие
нейромедиаторы образуются путем декарбоксилирования небелковых аминокислот. Так,
из 3,4-дигидроксифенилаланина (дофа) образуется медиатор дофамин. Дофамин
является одновременно предшественником катехоламинов адреналина и норадреналина
(см. с. 342). Нарушения метаболизма дофамина служат причиной болезни
Паркинсона. Из триптофана через промежуточный 5-гидрокситриптофан образуется
серотонин, соединение с широким спектром действием.
Многие моноамины и катехоламины
инактивируются аминоксидазой (моноаминоксидазой, "МАО") путем дезаминирования с
одновременным окислением в альдегиды. Следовательно, ингибиторы МАО играют
важную роль при фармакологическом воздействии на метаболизм
нейромедиаторов.