


Метаболизм. Энергетика
Дыхательная цепь
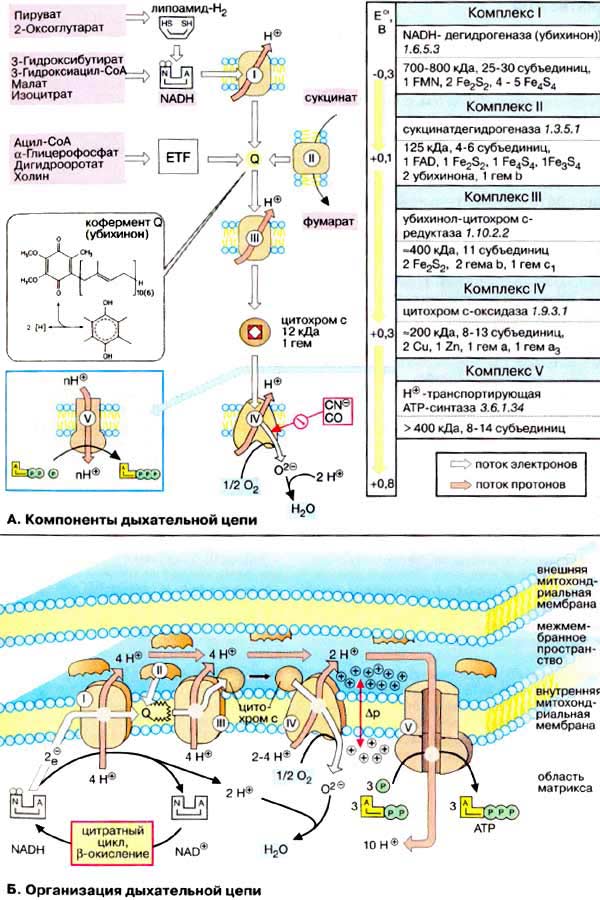 Дыхательная цепь является частью
процесса окислительного фосфорилирования (см. с. 126). Компоненты
дыхательной цепи катализируют перенос электронов от НАДН + Н+ или
восстановленного убихинона (QH2) на молекулярный кислород. Из-за
большой разности окислительно-восстановительных потенциалов донора (НАДН +
Н+ и, соответственно, QH2) и акцептора (О2)
реакция является высокоэкзергонической (см. с. 24). Большая часть
выделяющейся при этом энергии используется для создания градиента протонов (см.
с. 128) и, наконец, для образования АТФ с помощью
АТФ-синтазы.
Дыхательная цепь является частью
процесса окислительного фосфорилирования (см. с. 126). Компоненты
дыхательной цепи катализируют перенос электронов от НАДН + Н+ или
восстановленного убихинона (QH2) на молекулярный кислород. Из-за
большой разности окислительно-восстановительных потенциалов донора (НАДН +
Н+ и, соответственно, QH2) и акцептора (О2)
реакция является высокоэкзергонической (см. с. 24). Большая часть
выделяющейся при этом энергии используется для создания градиента протонов (см.
с. 128) и, наконец, для образования АТФ с помощью
АТФ-синтазы.
А. Компоненты дыхательной
цепи
Дыхательная цепь включает три белковых
комплекса (комплексы I, III и IV), встроенных во внутреннюю
митохондриальную мембрану, и две подвижные молекулы-переносчики -
убихинон (кофермент Q) и цитохром с. Сукцинатдегидрогеназа, принадлежащая
собственно к цитратному циклу, также может рассматриваться как комплекс II
дыхательной цепи. АТФ-синтаза (см. с. 144) иногда называется
комплексом V, хотя она не принимает участия в переносе
электронов.
Комплексы дыхательной цепи построены из
множества полипептидов и содержат ряд различных
окислительно-восстановительных коферментов, связанных с белками (см. сс.
108, 144). К ним принадлежат флавин [ФМН (FMN)
или ФАД (FAD), в комплексах I и II], железо-серные центры (в I, II и III) и группы гема
(в II, III и IV). Детальная структура большинства комплексов еще не
установлена.
Электроны поступают в дыхательную цепь
различными путями. При окислении НАДН + Н+ комплекс I
переносит электроны через ФМН и Fe/S-центры на убихинон. Образующиеся при
окислении сукцината, ацил-КоА и других субстратов электроны переносятся на
убихинон комплексом II или другой митохондриальной дегидрогеназой
через связанный с ферментом ФАДН2 или флавопротеин (см. с. 166),
При этом окисленная форма кофермента Q восстанавливается в ароматический
убигидрохинон. Последний переносит электроны в комплекс III,
который поставляет их через два гема b, один Fe/S-центр и гем с1 на
небольшой гемсодержащий белок цитохром с. Последний переносит электроны к
комплексу IV, цитохром с-оксидазе. Цитохром с-оксидаза содержит для
осуществления окислительно-восстановительных реакций два медьсодержащих центра
(CuA и CuB) и гемы а и а3, через которые
электроны, наконец, поступают к кислороду. При восстановлении
О2 образуется сильный основной анион О2-, который
связывает два протона и переходит а воду. Поток электронов сопряжен с
образованным комплексами I, III и IV протонным градиентом.
Б. Организация дыхательной
цепи
Перенос протонов комплексами I, III и IV
протекает векторно из матрикса в межмембранное пространство. При переносе
электронов в дыхательной цепи повышается концентрация ионов H+, т. е.
понижается значение рН. В интактных митохондриях по существу только
АТФ-синтаза (см. с. 144) позволяет осуществить обратное движение протонов
в матрикс. На этом основано важное в регуляторном отношении сопряжение
электронного переноса с образованием АТФ (см. с. 146).
Как уже упоминалось, все комплексы с I
по V интегрированы во внутренней мембране митохондрий, тем не менее обычно они
не контактируют друг с другом, так как электроны переносятся убихиноном и
цитохромом с. Убихинон благодаря неполярной боковой цепи свободно перемещается в
мембране. Водорастворимый цитохром с находится на внешней стороне
внутренней мембраны.
Окисление НАДН (NADH) комплексом I
происходит на внутренней стороне мембраны, а также в матриксе, где происходит
также цитратный цикл и β-окисление - самые важные источники НАДН. В матриксе
протекают, кроме того, восстановление O2 и образование АТФ (ATP).
Полученный АТФ переносится по механизму антипорта (против АДФ) в межмембранное
пространство (см. с. 214), откуда через порины проникает в
цитоплазму.