


Молекулярная генетика
Рибосомы: элонгация,
терминация
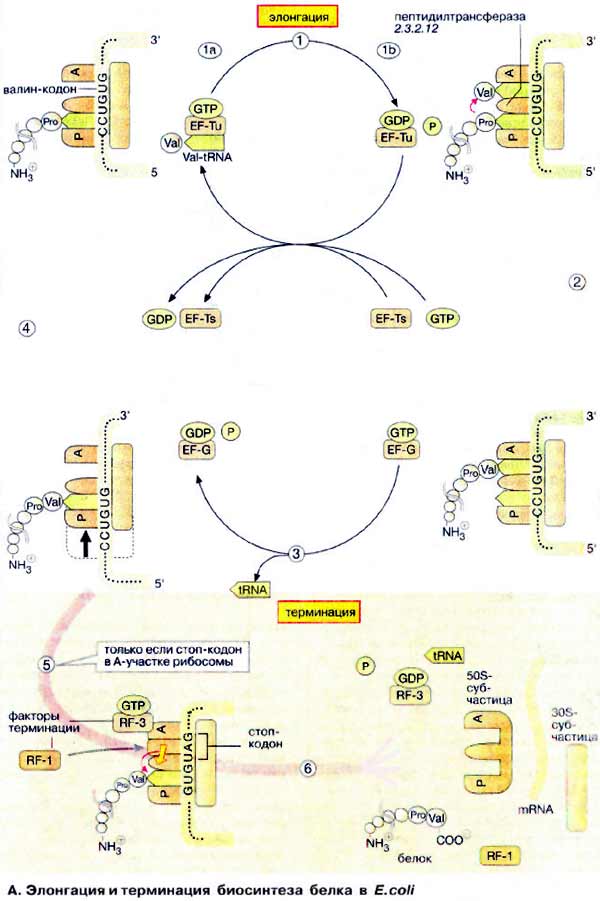 После завершения стадии инициации (см.
с. 246) к растущей полипептидной цепи присоединяются другие аминокислоты
(элонгация) до тех пор, пока рибосома не достигнет стоп-кодона на мРНК и
процесс не прекратится (терминация).
После завершения стадии инициации (см.
с. 246) к растущей полипептидной цепи присоединяются другие аминокислоты
(элонгация) до тех пор, пока рибосома не достигнет стоп-кодона на мРНК и
процесс не прекратится (терминация).
А. Элонгация и терминация биосинтеза белка в E. coli
Элонгацию можно разделить на три
стадии. В первой пептидильный участок (P) рибосомы занимает тРНК
(tRNA), несущая на 3'-конце растущую пептидную цепь (на схеме вверху слева)
Затем вторая тРНК, соединенная с соответствующей аминокислотой (на рисунке
показана Val-тPHKVal), взаимодействует своим антикодоном (см. с. 88)
с кодоном мРНК, фиксированным на акцепторном участке (А, в данном
случае GUG).
тРНК связывается в виде комплекса с
ГТФ-содержащим белком, фактором элонгации Tu (EF-Tu) (1а). Диссоциация
комплекса происходит только после того, как связанный ГТФ (GTP) гидролизуется до
ГДФ (GDP) и фосфата (1б). До гидролиза ГТФ взаимодействие тРНК с мРНК (mRNA)
относительно слабое. Таким образом, гидролиз ГТФ с участием комплекса служит
лимитирующим фактором, дающим время для проверки, правильно ли связана тРНК.
Затем следующий белок, фактор элонгации Ts (EF-Ts), катализирует обмен ГДФ на
ГТФ и таким образом регенерирует комплекс EF-Tu · GTP.
Собственно синтез пептидной связи
происходит на следующей стадии (2). Рибосомная 'пептидилтрансфераза'
катализирует (без потребления АТФ) перенос растущей пептидной цепи от тРНК,
находящейся в Р-участке, на аминогруппу валинового остатка, присоединенного к
тРНКVаl, связанной на А-участке. Пептидилтрансферазная
активность рибосом зависит не от какого-либо рибосомного белка, а, скорее
всего, связана с 28S-PHK. Каталитически активные РНК получили название
рибозимов (см. с. 242). Предполагают, что существующие рибозимы можно
рассматривать как реликты 'мира РНК', раннего периода биохимической эволюции,
когда белки еще не получили такого распространения и не приобрели такого
значения, как в последующие периоды.
После переноса растущей цепи в
А-участок, свободная аминоацил-тРНК диссоциирует от Р-участка (3) и с рибосомой
связывается другой ГТФ-содержащий фактор элонгации (EF-G · GTP). Гидролиз ГТФ
этим фактором дает энергию для транслокации рибосомы (3). Во время этого
процесса рибосома сдвигает мРНК на три основания в направлении 3'-конца.
Поскольку тРНК, несущая полипептидную цепь, не меняет положения относительно
мРНК, она попадает в Р-участок рибосомы, в то время как следующий кодон мРНК (в
данном случае GUG), попадает в А-участок. Теперь рибосома готова для вступления
в следующий цикл элонгации (4).
Когда один из стоп-кодонов (UAG, UAA или
UGA) попадает в Α-участок, наступает терминация трансляции (5). Для
стоп-кодонов нет соответствующих тРНК. Вместо этого с рибосомой связываются два
белковых, высвобождающих фактора (англ. relising factor, RF). Один из
них, RF-1, катализирует гидролитическое расщепление эфирной связи между тРНК и
С-концом пептида, тем самым высвобождая белок. Энергию для диссоциации комплекса
на составляющие компоненты поставляет ГТФ-содержащий фактор RF-3
(6).
Синтез белка требует высоких
энергетических затрат. При присоединении одной аминокислоты к растущему
полипептиду гидролизуется четыре макроэргические связи. Две молекулы АТФ
гидролизуются при активации аминокислоты (см. рис. 239, АТФ → АМФ + неорганический
фосфат), и две молекулы ГТФ расходуются во время элонгации. Кроме того, при
инициации и терминации на каждую молекулу белка расходуется по одной молекуле
ГТФ.
Дополнительная
информация
Клетки эукариот содержат больше факторов
инициации и вследствие этого имеют более сложную структуру комплекса инициации.
Главную роль в инициации играет кэп-структура 5'-конца эукариотической мРНК (см.
с. 242), хотя в принципе элонгация и терминация протекают по аналогичной схеме.
Отдельные стадии трансляции в бактериях могут ингибироваться антибиотиками (см.
с. 250).